Болезнь Вильсона — Коновалова является врожденным нарушением метаболизма меди в организме. Оно приводит к тяжелым патологиям нервной системы, передающимся по наследству.
Впервые заболевание было описано в 1912 г. британским неврологом Сэмюэлем Вильсоном. В 1960 г.
российский ученый Николай Коновалов добавил в определение болезни понятие «гепатоцеребральная дистрофия», изучил патогенез и клинические проявления.
Этиология и патогенез болезни Вильсона
Ген, отвечающий за развитие заболевания, расположен в 13 хромосоме. Он участвует в транспортации меди в желчь и включает ее в церулоплазмин.
Болезнь Вильсона наследуется, как рецессивный аутосомный признак, и возникает даже при небольшой мутации гена. При таком типе наследования заболеть можно, получив дефектный носитель обязательно от обоих родителей.
Люди, имеющие только один пораженный ген, не страдают от болезни Вильсона, но могут ощущать незначительные нарушения метаболизма меди.
В организме здорового человека содержится в среднем не более 100 мг меди, при этом суточная потребность в ней — 1-2 мг. Излишняя часть вещества абсорбируется печенью и выводится с желчью.
Болезнь Вильсона приводит к нарушению сразу двух процессов: биосинтеза церулоплазмина — белка, связывающего медь, и ее выведения естественным путем.
Из-за этого допустимая концентрация вещества в организма значительно повышается, происходит его отложение в различных органах:
- почках;
- роговице глаза;
- печени;
- головном мозге.
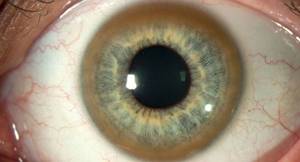
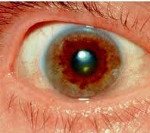
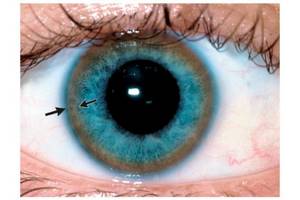
Важно! Критическое увеличение нормы меди приводит к токсическому поражению разных органов. Печень подвергается циррозу, чаще всего — крупноузловому. В головном мозге нарушается работа мозжечка, а в глазу формируется кольцо Кайзера-Флейшера.
Клиническая картина болезни Вильсона
Еще одним распространенным названием заболевания является гепатолентикулярная дегенерация. При описании клинической картины обязательно указываются форма, выраженность нарушений со стороны нервной системы, уровень печеночной недостаточности. Код по МКБ 10 определяется как Е83.0.
Клинические проявления болезни возникают в раннем возрасте, они схожи с симптомами многих заболеваний печени. Большинство пациентов страдают от желтухи, астении, анорексии. У многих женщин отмечают постоянно повышенную температуру тела.
Печень больных насыщается медью, происходит накопление этого вещества во всем организме, в том числе нервной системе. Это отрицательно сказывается на мимике, моторике, координации движений. Интеллект при этом сохраняется, но поведение человека становится агрессивным.
Происходит превышение допустимого количества меди в роговице глаза, что сопровождается появлением на ней коричневого кольца. Его обнаруживают при помощи щелевой лампы, но только у пациентов старше 5 лет.
Синдром Вильсона — Коновалова характеризуется клиническим полиморфизмом, в процесс вовлекаются органы выделительной и нервной систем. Заболевание имеет рецессивные признаки, которым предшествуют висцеральные и желудочно-кишечные расстройства. В клинической картине описывают гепатолиенальный синдром, застой кровотока и мышечную ригидность без нарушения чувствительности.
Причины развития болезни Вильсона — Коновалова
Единственной причиной возникновения и развития заболевания является мутация гена, отвечающего за метаболизм меди. Обнаружено более 100 различных отклонений в данном носителе, поэтому анализ возможных нарушений ДНК — достаточно малоэффективная процедура.
Внимание! Предупредить появление болезни невозможно, она является врожденной. У детей уже к 2-3 годам жизни патология приводит к нарушениям работы печени.
Формы и симптомы болезни
В зависимости от основных признаков выделяют три основные формы болезни Вильсона — Коновалова. Это патология, приводящая к серьезным поражениями печени; заболевание, поражающее нервную систему; смешанная форма. В соответствии с этими типами у пациента преобладают те или иные симптомы.
Печеночная форма
Печеночная или брюшная форма болезни Вильсона развивается у людей до 40 лет и характеризуется поражением печени, схожим с циррозом. Кроме того, пациенту диагностируют хронический гепатит. В 80% случаев эта форма имеет следующие симптомы:
- метеоризм;
- снижение уровня активности;
- тупая боль в правом подреберье;
- увеличение количества жидкости в брюшной полости;
- периодические носовые кровотечения;
- утолщение пальцев ног и рук;
- желтуха;
- лихорадка;
- увеличение размеров селезенки.
Неврологическая форма
Эта форма болезни отличается проявлениями в очень раннем возрасте: мышечной ригидностью, нарушениями речи, небольшим постепенным снижением интеллектуальных способностей. Наблюдаются периоды обострения и ремиссии. У пациентов в возрасте 10-25 лет отмечают тремор, брадилалию. Они медленно пишут, читают, разговаривают, бесцельно повторяют движения руками.
Редкие симптомы
У 15% пациентов отмечают такие главные симптомы, присутствующие как комплексно, так и по отдельности:
- гемолитическая анемия;
- поражение почек;
- посинение или гиперпигментация кожных покровов и ногтей;
- хрупкость костей, приводящая к постоянным переломам;
- артроз;
- глухота;
- гинекомастия.
Течение болезни Вильсона
Существуют острый и хронический клинические типы течения заболевания. Кроме того, врачи определяют латентную стадию, которая длится не более 7 лет.
При этом все основные симптомы присутствуют, но не сказываются на качестве жизни, так как выражены слабо. Иногда заболевание практически не проявляет себя до 5 лет.
Пик болезни приходится на 8-15 лет, но уже с рождения диагностируют проблемы с печенью. Развитие патологии имеет свои особенности в зависимости от типа течения:
- Острое. Недуг доставляет немало беспокойств уже в раннем возрасте, все симптомы обострены и очень быстро приумножаются. Организм человека угасает очень быстро, лечение почти не помогает и не облегчает состояние. Быстрый летальный исход неизбежен в 90% случаев.
- Хроническое. Болезнь развивается медленно, сначала может быть латентной. Поражается сначала печень, после — органы нервной системы. В юношеском возрасте у пациентов отмечают нарушение походки и координации движений, редко — истерию. Выраженность всех симптомов средняя, прогрессируют они медленно.
К какому врачу обратиться
Диагностика и лечение заболевания проводятся гастроэнтерологом, нефрологом и гепатологом. Поскольку патология напрямую связана с неврологией и генетикой, то соответствующих специалистов также привлекают к проведению комплексного обследования пациента.
Кроме того, прибегают к профессиональным консультациям офтальмолога, дерматолога, эндокринолога, ревматолога.
Только благодаря совместным усилиям этих узкопрофильных специалистов удается поставить правильный диагноз и определить больного для наблюдения в специальное медицинское учреждение.
Диагностика
Для начала врачи собирают анамнез, проводят внешний осмотр. По результатам оценивают степень поражения организма, дают клинические рекомендации, назначают следующие анализы:
- Крови и мочи. С целью определения процента содержания церулоплазмина и меди в организме.
- Исследование с применением щелевой лампы у окулиста для обнаружения наличия кольца Кайзера-Флейшера.
- Генетические тесты пациента и его родственников.
- УЗИ органов брюшной полости.
- МРТ головного мозга.
- Биопсию печени.
Справка! Перечисленные простые и доступные методы диагностики позволяют исключить прочие заболевания, имеющие схожие симптомы. Кроме того, обследование поможет подобрать корректное поддерживающее лечение.
Лечение болезни
Лечение болезни Вильсона направлено на уменьшение поступления меди в организм и снижение ее концентрации. В первом случае достаточно придерживаться специальной диеты.
Она предусматривает отказ от таких продуктов, как баранина, свинина, кальмары, креветки, крабы, грибы, сухофрукты, бобовые, соя, шоколад.
Вместе с тем больным можно не ограничивать себя в употреблении яиц, мяса курицы, многих овощей и фруктов, хлеба, молока, чая.
Для того чтобы уменьшить количество меди, имеющейся в организме, врачи выписывают пожизненный прием иммуносупрессивных и противовоспалительных средств, цинксодержащих и желчегонных препаратов, антиоксидантов.
Важно! Пациент не может самостоятельно устанавливать или менять дозировку препаратов, которая подбирается сугубо индивидуально в соответствии с результатами анализов. Лекарственные средства должны дополняться витаминными и минеральными комплексами (без меди в составе).
В случае неэффективности медикаментозного лечения больному предлагают хирургическое вмешательство. Ему транспортируют здоровую печень, но прием поддерживающих препаратов не прекращают.
Прогноз и профилактика болезни Вильсона
Благоприятный прогноз возможен только при условии соблюдения диеты и своевременного лечения высокоэффективными препаратами. Важно, чтобы лечебные мероприятия были начаты до того, как печень и элементы нервной системы были необратимо поражены.
Прием лекарственных средств позволяет уменьшить и даже полностью ликвидировать симптомы со стороны нервной системы, улучшить состояние печени.
Пациент лучше себя чувствует уже спустя полгода от начала лечения, а через 2-3 года качество его жизни заметно улучшается.
Без лечения или при его низкой эффективности смерть наступает уже в возрасте 35-40 лет в результате печеночной недостаточности или ее осложнений. Если врач обнаружил серьезные поражения печени, нужна трансплантация. Считается, чем раньше ее делают, тем лучше приживается новый орган. Так, среди 20-летних пациентов выживаемость составляет около 80%.
Специфической профилактики этой генетической болезни не существует. Тем, кто в группе риска, рекомендуется пройти полное обследование, вести здоровый образ жизни, полностью отказаться от приема алкоголя. Если больная женщина вынашивает ребенка, она не должна прекращать лечение. Ей нужно обратиться к врачу, чтобы скорректировать дозировку медикаментов.
Возможные осложнения
В связи с тем, что болезнь поражает печень, нервную систему, вероятные осложнения делятся на такие основные группы:
- Тяжелые заболевания печени. К одним из них относят цирроз, возникающий у большинства пациентов. Прогрессирует он медленно, сопровождается желтушностью кожных покровов, деформацией пальцев рук и ног, расширенными венами на передней брюшной стенке, отеками голеней. Часто больные страдают от кровотечений, возникающих в желудке. Развивается печеночная недостаточность, симптомами которой являются сонливость, поведенческие расстройства, на последней стадии — кома.
- Смерть. Летальный исход ожидает более 70% больных, страдающих от печеночной недостаточности, в особенности — фульминантной.
- Неврологические нарушения. Сюда относят мышечную дистонию, дизартрию, расстройства личности и поведения, эпилептические припадки.
- Невозможность забеременеть у женщин.
Болезнь Вильсона — Коновалова у детей
Заболевание определяется врачами как причина 20% всех патологий печени у детей. Если у ребенка обнаружены симптомы нарушений в работе этого органа, в первую очередь специалисты проводят обследование, чтобы исключить или подтвердить болезнь Вильсона — Коновалова.
Недуг может иметь разную форму течения: у одних детей он проявляется уже к 2 годам, у других — только к 8. Как правило, с точностью определить наличие заболевания удается только в 5-летнем возрасте.
Наиболее выражена болезнь у пациентов младшего школьного возраста и в пубертатном периоде, то есть 7-17 лет.
Еще полстолетия назад люди, страдающие от болезни Вильсона — Коновалова, не доживали и до 30 лет. Сегодня же средняя продолжительность их жизни увеличилась почти вдвое. Современная медицина позволяет облегчить состояние пациента, уменьшить проявление основных симптомов, поддержать здоровье внутренних органов.
Источник: https://onevrologii.ru/nasledstvennye-zabolevaniya/vse-o-bolezni-vilsona-konovalova
Болезнь Вильсона
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФазы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Болезнь Вильсона может протекать в брюшной, ригидно-аритмогиперкинетической, дрожательной или экстрапирамидно-корковой форме. Диагностика болезни Вильсона включает офтальмологическое обследование, биохимические анализы мочи и крови, МРТ или КТ головного мозга. Основу патогенетической терапии составляют тиоловые препараты, которые могут приниматься в течении нескольких лет и даже пожизненно.
E83.0 Нарушения обмена меди
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФ-азы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях.
Первооткрыватель заболевания — А.К. Вильсон, описавший заболевание в 1912 году, в отечественной медицине — Н.А. Коновалов. Патогенез болезни Вильсона был выявлен в 1993 году.
Понятию «болезнь Вильсона» соответствуют также: болезнь Вильсона-Коновалова, болезнь Вестфаля-Вильсона-Коновалова, дистрофия гепатоцеребральная, дистрофия гепатолентикулярная, дегенерация лентикулярная прогрессирующая.
Болезнь Вильсона
Ген АТР7В картирован на длинном плече хромосомы 13 (13q14.3-q21.1). Организм человека содержит около 50-100 мг меди. Суточная потребность меди для человека — 1-2 мг.
95% абсорбированной в кишечнике меди, транспортируется в форме комплекса с церулоплазмином (один из глобулинов сыворотки, синтезируемых печенью) и только 5% в форме комплекса с альбумином.
Кроме того, ион меди входит в состав важнейших метаболических ферментов (лизилоксидаза, супероксиддисмутаза, цитохром-С-оксидаза и др.).
При болезни Вильсона происходит нарушение двух процессов обмена меди в печени — биосинтез главного медьсвязывающего белка (церулоплазмина) и выведение меди с желчью, следствием чего становится повышение уровня несвязанной меди в крови. Концентрация меди в различных органах (чаще всего в печени, почках, роговице и головном мозге) увеличивается, что приводит к их токсическому поражению.
Согласно классификации Н.В. Коновалова различают пять форм болезни Вильсона:
- брюшная
- ригидно-аритмогиперкинетическая
- дрожательно-ригидная
- дрожательная
- экстрапирамидно-корковая
Для болезни Вильсона характерен клинический полиморфизм. Первые проявления заболевания могут появиться в детстве, юношестве, в зрелом возрасте и гораздо реже в зрелом возрасте.
В 40-50% случаев Болезнь Вильсона манифестирует с поражения печени, в остальных — с психических и неврологических расстройств.
С вовлечением в патологический процесс нервной системы обнаруживается кольцо Кайзера-Флейшера.
Брюшная форма развивается преимущественно до 40 лет. Характерный признак — тяжелое поражение печени по типу цирроза печени, хронического гепатита, фульминантного гепатита.
Ригидно-аритмогиперкинетическая форма манифестирует в детском возрасте. Начальные проявления — мышечная ригидность, амимия, смазанность речи, трудности при выполнении мелких движений, умеренное снижение интеллекта. Для этой формы заболевания характерно прогрессирующее течение, с наличием эпизодов обострения и ремиссии.
Дрожательная форма возникает в возрасте от 10 до 30 лет. Преобладающим симптомом является тремор. Кроме того, могут наблюдаться брадикинезия, брадилалия, тяжелый психоорганический синдром, эпилептические приступы.
Экстрапирамидно-корковая форма встречается весьма редко. Ее начало схоже с началом какой-либо из вышеперечисленных форм. Для нее характерны эпилептические припадки, экстрапирамидные и пирамидные нарушения и выраженный интеллектуальный дефицит.
Офтальмологическое исследование с помощью щелевой лампы выявляет кольцо Кайзера-Флейшера. Биохимические исследования мочи обнаруживают повышенную экскрецию меди в суточной моче, а также снижение концентрации церулоплазмина в крови. С помощью визуализационных методов (КТ и МРТ головного мозга) обнаруживают атрофию полушарий большого мозга и мозжечка, а также базальных ядер.
При диагностике болезни Вильсона неврологу необходимо дифференцировать ее от паркинсонизма, гепатоцеребрального синдрома, болезни Геллервордена-Шпатца. Основным дифференциально-диагностическим признаком этих заболеваний является отсутствие характерных для болезни Вильсона кольца Кайзера-Флейшера и расстройств обмена меди.
Основой патогенетического лечения является назначение тиоловых препаратов, в первую очередь — D-пеницилламина либо унитиола. Главное преимущество купренила — низкая токсичность и возможность длительного приема при отсутствии побочных эффектов.
Его назначают по 0,15 г (1 капсула) в сутки (только после еды), в дальнейшем, в течение 2,5-3 месяцев дозу увеличивают до 6-10 капсул/сутки (оптимальная доза).
Лечение D-пеницилламином проводится годами и даже пожизненно с небольшими перерывами (на 2-3 недели) в случае появления побочных эффектов (тромбоцитопения, лейкопения, обострения язвенной болезни желудка и т. д.).
Унитиол назначают в случае непереносимости (плохой переносимости) D-пеницилламина. Длительность одного курса лечения — 1 месяц, после чего лечение приостанавливают на 2,5-3 месяца.
В большинстве случаев наступает улучшение общего состояния пациента, а также регресс неврологических симптомов (скованности, гиперкинезов).
В случае доминирования гиперкинезов рекомендовано назначение небольших курсов нейролептиков, при ригидности — леводопы, карбидопы, тригексифенидила.
В случае тяжелого течения болезни Вильсона, при неэффективности консервативного лечения за рубежом прибегают к трансплантации печени. При положительном исходе операции состояние пациента улучшается, восстанавливается обмен меди в организме. В дальнейшем лечение пациента составляет иммуносупрессивная терапия.
В России на сегодня постепенно внедряется в клиническую практику метод биогемоперфузии с изолированными живыми клетками селезенки и печени (т. н. аппарат «вспомогательная печень). Немедикаментозное лечение состоит в назначении диеты (стол №5) в целях исключения продуктов богатых медью (кофе, шоколад, бобовые, орехи и т.
д.).
В случае своевременного диагностирования болезни Вильсона и проведения адекватной медьснижающей терапии возможна нормализация общего состояние пациента и обмена меди в организме. Постоянный прием тиоловых препаратов по схеме, назначенной врачом-специалистом, позволяет поддерживать профессиональную и социальную активность пациента.
Для предотвращения рецидивов болезни Вильсона рекомендовано проведение лабораторных исследований крови и мочи пациента несколько раз в год. Необходим контроль следующих показателей: концентрация меди, церулоплазмина и цинка. Кроме того, рекомендовано проведение биохимического анализа крови, общего анализа крови, а также регулярные консультации у терапевта и невролога.
Источник: https://www.KrasotaiMedicina.ru/diseases/zabolevanija_neurology/wilsons
Болезнь Вильсона
Болезнь Вильсона — это заболевание, передающееся по наследству, его причина заключается в нарушении накопления и транспорта меди в организме, вследствие чего происходит хроническая интоксикация.
В крови понижается концентрация белка, который транспортирует медь, церрулоплазмина.
Полное название болезни звучит как Болезнь Вильсона-Коновалова, гепатоцеребральная дистрофия, гепатолентикулярная дегенерация, болезнь Вестфаля-Вильсона-Коновалова.
Содержание статьи:
Патология провоцирует множественные наследственные заболевания внутренних органов и центральной нервной системы, особенно печени и промежуточного мозга. Передается это заболевание по аутосомно-рецессивному типу. Патологический ген ATP7B (находится в 13 хромосоме) мутирует, что и вызывает нарушения.
В случае, если человек получает дефектный ген от обоих родителей, болезнь начинает проявляться и прогрессировать. Человек, имеющий один патологический мутантный ген является носителем заболевания, концентрация меди отклонена от нормы, но нарушения незначительны.
Диагностирование заболевания приходится на возраст 10-13 лет. Болезнь проявляет себя как смешанный цирроз печени или почечная недостаточность. Чаще болеют мальчики. Распространённость болезни Вильноса повышается среди народностей, у которых популярны браки между кровными родственниками.
Классификация болезни Вильсона
Советский невропатолог Н.В. Коновалов, который занимался изучением патофизиологии, патогенеза, клиники данного заболевания, классифицировал болезнь, выделив пять ее форм:
- Брюшная: когда поражается печень, что приводит к смерти больного раньше, чем проявляются симптомы, диагностируется в детском возрасте, продолжительность — до пяти лет.
- Ригидно-аритмогиперкинетическая — быстро прогрессирующая форма, наблюдается в детском возрасте, характеризуется мышечной ригидностью, замедленностью движений, образованием контрактур, наблюдаются судорожный смех и плач, присутствует задержка в развитии.
- Дрожательная: наблюдается во взрослом возрасте (20-30 лет), прогрессирует медленно (около 10 лет), характеризуется дрожанием. На последней стадии появляется ригидность, наблюдается анемия, заторможенность и монотонность речи, тяжелая деградация психики, свойственны эпилептические припадки.
- Дрожательно-ригидная — самая распространённая форма, наблюдается в подростковом возрасте, развивается тяжелая ригидность и сильное дрожание, симптомы усиливаются при волнении или физическом напряжении мышц, сопровождается дисфагией и дизартрией, прогрессирует около шести лет.
- Экстрапирамидно-корковая — встречается редко, отягощается пирамидными парезами, эпилептическими припадками и тяжелой степенью слабоумия из-за сильного размягчения больших полушарий головного мозга.
Этиология и патогенез болезни Вильсона
Переизбыток меди ведет к сильнейшей интоксикации организма — окислению клеточных мембран, дестабилизации ядерной ДНК. Выявлено более двухсот модификаций мутирующего гена.
Патогенез болезни Вильсона-Коновалова заключается в нарушении поступления меди в организм и ее выведении. Нарушения в процессе нормальной экскреции меди из организма связаны с недостачей протеина Р-типа.
Также происходят нарушения состава церулоплазмина, который синтезируется в печени и включает в свой состав медь.
Токсикация организма из-за переизбытка меди отражается, в первую очередь, на печени, где медь накапливается в особенно больших количествах, поражая орган.
Следующим местом скопления меди можно назвать центральную нервную систему. Более всего страдают базальные ганглии головного мозга, провоцируя тяжёлые нейропсихические нарушения. Отложения меди видны и в роговице глаза — так называемое кольцо Кайзера-Флейшера. Медь поражает также сердце и суставы.
Клиническая картина болезни Вильсона
Болезнь Вильсона-Коновалова разделяют на две стадии:
- Латентная (длится около 6 лет).
- Стадия клинических проявлений.
Болезнь выявляет себя в возрасте 7-15 лет. Опираясь на симптоматику болезни, выделяют три ее формы:
- С поражением печени.
- С поражением нервной системы.
- Смешанная.
У детей заболевание чаще всего проявляется циррозом печени, диагностируются случаи развития болезни Вильсона после желтухи, анорексии, повышенной температуры, почечной недостаточности.
Нарушения психики у пациентов наблюдаются в юношеском возрасте, и означают, что печень уже перенасыщена медью и этот микроэлемент стал накапливаться в центральной нервной системе. В этом периоде у больного наблюдаются нарушения мимики, координации движений, артикуляционного и речевого аппаратов.
В некоторых случаях проявляются симптомы неврологического и психического расстройства. Нарушения психики связаны сразнообразными фобиями, агрессивным поведением, но с сохранением интеллектуальных способностей. Некоторым больным присущи гематологические синдромы.
Болезнь Вильсона поражает кожные покровы (наличие пигментных пятен), кости становятся очень хрупкими (повышается травмоопастность), поражаются суставы (артриты), эндокринная система.
Диагностика болезни Вильсона
Диагностика начинается с визуального обследования больного и выяснения семейной истории болезни:
- анализ изменения цвета кожных покровов (наличие пигментации);
- наличие желто-коричневого кольца по краю роговицы глаза;
- пальпация печени укажет, есть ли изменения органа в объемах.
Далее следуют лабораторные анализы:
- Общий и биохимический анализы крови. Анализ количества меди в крови (у больных более 1,5 тысяч миллиграмм на литр), дозирование церулоплазмина.
- Анализ мочи на концентрацию в ней меди.
- Биопсия печени.
Проводят также и генетическое обследование, которое дает самую точную информацию о больном. После этого лечащим врачом ставится дифференциальный диагноз.
Дифференциальный диагноз
Невролог должен отличить болезнь Вильсона от ряда похожих заболеваний, например, болезни Паркинсона и ее модификации, цирроза печени, имеющего отличительную от болезни Вильсона природу, различных наследственных поражений печени.
Лечение болезни Вильсона
Лечение данной болезни направлено на ограничение поступления меди в организм больного и уменьшение накопленных запасов.
С этой целью применяются различные методы лечения:
- Немедикаментозный метод — изменение образа жизни больного (диета, отказ от алкоголя и гепатотоксических медицинских препаратов). Исключаются из рациона продукты с высоким показателем меди (мясо, морепродукты, сухофрукты, грибы, шоколад, некоторые виды бакалеи, фрукты).
- Медикаментозное лечение. Начинается с момента установления диагноза и до конца жизни пациента. Непрерывность и качество медикаментозного лечения — залог повышения выживаемости больных. Купренил (хелатор меди) — главный препарат в лечении болезни Вильсона. При повышении дозы употреблениякупренила медь выводится с мочой. Существуют определенные дозы и специфика приема препарата, которая устанавливается, исходя из анализа состояния пациента и протекания его болезни.
- Хирургическое лечение (трансюгулярное внутрипочечное шунтирование).
Прогноз при болезни Вильсона
Прогноз зависит от своевременного лечения. Вовремя выявленная болезнь и адекватное ее лечение может привести к полному исчезновению симптомов. Но женщины с этим заболеванием редко становятся матерями. Запоздалое лечение или его отсутствие обычно приводит к летальному исходу. Иногда пациенту требуется трансплантация печени.
Профилактика болезни Вильсона
Точных рекомендаций по профилактике болезни Вильсона нет. Родственникам больного следует пройти генетическую экспертизу и периодически проходить консультацию у невролога.
Источник: https://www.mosmedportal.ru/illness/bolezn-vilsona/
Современное лечение болезни Коновалова-Вильсона
БОЛЕЗНЬ ВИЛЬСОНА — КОНОВАЛОВА (Гепатолентикулярная дегенерация) Это тяжелое прогрессирующее экстрапирамидное заболевание, постоянным и характерным признаком которого является поражение печени. Заболевание наследственное, передается по аутосомно-рецессивному типу.
С помощью метода рекомбинации ДНК получены данные, свидетельствующие о локализации патологического процесса, ответственного за развитие болезни, на хромосоме 13.
Ведущую роль в патогенезе играет патология обмена меди, вследствие нарушения синтеза фермента церулоплазмина, которые приводят к отложению избыточного количества меди в различных органах и тканях (преимущественно в печени, мозге, почках и роговице) и развитию вследствие этого клинических симптомов болезни.
Поражение печени имеет характер крупноузлового или смешанного (крупноузлового и мелкоузлового) цирроза. Развитие цирроза печени может проходить через стадию хронического активного гепатита.
В почках медь откладывается главным образом в проксимальных отделах почечных канальцев, что приводит к нарушению реабсорбции целого ряда важных для организма соединений и может сопровождаться определенными метаболическими сдвигами. В результате отложения меди в десцеметовой мембране роговицы образуется роговичное кольцо Кайзера — Флейшера, которое является патогномоничным признаком болезни. В мозге медь преимущественно откладывается в базальных ганглиях, главным образом в скорлупе. Токсическое действие меди является важным фактором, приводящим к развитию морфологических изменений в мозговой ткани.
Этиология и патогенез.
Заболевание наследуется по аутосомно-рецессивному типу. Ген болезни расположен на длинном плече хромосомы 13, он клонирован и изучен. Ген кодирует переносящую медь-АТФазу, с которой связывается 6 атомов меди. К настоящему времени выявлено более 25 различных мутаций гена. Мутации на каждой из хромосом различны, что затрудняет установление соответствия между фенотипом и генотипом.
Существенно, что у гетерозиготных носителей заболевание не развивается. Нормальная концентрация меди в плазме крови составляет 100—120 мкг%, причем 93% этого количества находится в виде церулоплазмина и только 7% связано с сывороточными альбуминами. Медь в церулоплазмине связана прочно. Связь осуществляется в печени.
Церулоплазмин является b2-глобулином, и каждая его молекула содержит 8 атомов меди. Радиоизотопными методами установлено, что при гепатолентикулярной недостаточности нарушение связано с генетическим дефектом синтеза церулоплазмина, из-за чего содержание его резко снижено. При этом медь не может быть стабильно связана и откладывается в тканях.
В некоторых случаях содержание церулоплазмина остается нормальным, но меняется его структура (изменяется отношение фракций). Особенно тропна медь при синдроме Вильсона — Коновалова к печени, ядрам мозга, почкам, эндокринным железам, роговице. При этом медь начинает действовать как токсический агент, вызывая типичные дегенеративные изменения в этих органах.
Клиническая картина характеризуется разнообразием, что обусловлено повреждающим действием меди на многие ткани.
Преимущественное поражение того или иного органа зависит от возраста. У детей это в основном печень (печеночные формы). В дальнейшем начинают превалировать неврологическая симптоматика и нарушения психики (нейропсихические формы).
Если заболевание проявляется после 20 лет, то у больного обычно отмечается неврологическая симптоматика. Возможно сочетание симптомов обеих форм. У большинства больных в возрасте от 5 до 30 лет уже выражены клинические проявления заболевания и диагноз установлен.
Кольцо Кайзера — Флейшера представляет собой зеленовато-коричневое кольцо по периферии роговицы. Вначале оно появляется на верхнем полюсе. Для выявления кольца Кайзера — Флейшера больной, как правило, должен быть осмотрен окулистом с помощью шелевой лампы.
Оно выявляется у больных, имеющих неврологические симптомы, и может отсутствовать у молодых больных с острым началом заболевания.
Течение. Различают острую и хроническую формы.
Острая форма характерна для раннего возраста, развивается молниеносно и кончается летально, несмотря на лечение. Чаше встречается хроническая форма с медленным течением и постепенным развитием симптоматики. Раньше всего появляется экстрапирамидальная мышечная ригидность нижних конечностей (нарушение походки и устойчивости).
Постепенно формируется картина паркинсонизма, затем изменяется психика (параноидальные реакции, истерия). Иногда на первый план выступает печеночная недостаточность: увеличение печени, картина напоминает цирроз или хронический активный гепатит.
Диагностика.
Ведущим признаком является гипокупремия ниже 10 мкг%, много меди выделяется с мочой — свыше 100 мкг/сут.
Может быть положительная тимоловая проба. Важным симптомом является кольцо Кайзера — Флейшера. Уровни церулоплазмина и меди в сыворотке обычно снижены, КТ черепа, выполненная еще до появления неврологических симптомов, может выявить увеличение желудочков, а также другие изменения. МРТ обладает большей чувствительностью.
Она может выявить расширение III желудочка, очаги поражения в таламусе, скорлупе и бледном шаре. Эти поражения обычно соответствуют клиническим проявлениям заболевания. Генетические исследования (по Ш. Шерлок). Братья и сестры больного должны быть обследованы.
О гомозиготности свидетельствуют гепатомегалия, спленомегалия, сосудистые звездочки, небольшое повышение активности трансаминаз в сыворотке. Кольцо Кайзера — Флейшера выявляется не всегда. Уровень церулоплазмина в сыворотке обычно снижен до 0,20 г/л и менее. Биопсия печени с определением содержания меди позволяет подтвердить диагноз.
Отличить гомозигот от гетерозигот легко, хотя иногда могут возникнуть трудности. В таких случаях проводят анализ гаплотипов больного и его братьев и сестер. Гомозигот лечат пеницилламином, даже если заболевание протекает бессимптомно. Гетерозиготам лечение не требуется.
При наблюдении за 39 клинически здоровыми гомозиготами, получающими лечение, появления симптомов не отмечено, в то же время у нелеченых гомозигот развилась болезнь Вильсона и часть из них умерли. Использование ДНК-маркеров позволяет с высокой точностью установить диагноз болезни Вильсона.
Однако генетическое исследование имеет значительные ограничения, в числе которых высокая стоимость методики и значительная вариабельность мутаций гена болезни Вильсона.
В настоящее время это исследование проводится у детей, чьи близкие родственники страдают заболеванием, и когда стандартные тесты не дают однозначного ответа, подтверждающего или отрицающего диагноз болезни Вильсона.
Патоморфология печени. Закономерно выявляется баллонная дистрофия, многоядерность гепатоцитов, скопления гликогена и гликогеновая вакуолизация ядер. Характерна жировая инфильтрация гепатоцитов. Клетки Купфера обычно увеличены в размерах.
У некоторых больных эти изменения особенно ярко выражены; выявляются тельца Мэллори, что напоминает морфологическую картину острого алкогольного гепатита. У части больных наблюдаются изменения в печени, свойственные ХГ.
Гистологические изменения в печени при болезни Вильсона не являются диагностическими, однако выявление описанных выше изменений у молодых больных с циррозом печени позволяет заподозрить это заболевание.
Метод выявления меди окрашиванием рубеановой кислотой или родамином ненадежен, поскольку медь распределяется неравномерно и в узлах регенерации отсутствует. Накопление меди обычно происходит в перипортальных гепатоцитах и сопровождается появлением атипичных отложений липофусцина.
Возможно определение содержания меди в печени. Нормальное содержание меди в ткани печени 15—55 мкг на 1 г сухого вещества ткани печени. У пациентов с болезнью Вильсона эти значения увеличены и колеблются от 250 до 3000 мкг/г.
Электронная микроскопия.
Даже при бессимптомном течении заболевания выявляют аутофагические вакуоли и крупные измененные митохондрии. Жировая инфильтрация может быть связана с повреждением митохондрий. Можно видеть инфильтрацию межклеточного пространства волокнами коллагена, а также светлые и темные клетки печени.
Дифференциальную диагностику проводят с острым и хроническим гепатитом, при котором уровень церулоплазмина может быть снижен из-за нарушения его синтеза в печени.
Недоедание также способствует снижению уровня церулоплазмина. При приеме эстрогенов, пероральных контрацептивов, при обструкции желчных путей, при беременности уровень церулоплазмина может повышаться. Суточная экскреция меди при болезни Вильсона повышена.
Во избежание искажения результатов анализа рекомендуется собирать мочу в специальные бутылки с широким горлом с пакетами-вкладышами одноразового пользования, не содержащими медь. При наличии противопоказаний к биопсии печени при нормальном уровне церулоплазмина в сыворотке заболевание можно диагностировать по степени включения в церулоплазмин перорально принимаемой радиоактивной меди.
Лечение. Требуется диета с исключением продуктов, содержащих большее количество меди (шоколад, какао, горох, печень, ржаной хлеб).
Лекарственная терапия проводится на протяжении всей жизни с момента устаноаления диагноза или обнаружения гомозиготного носительства дефектного гена и является залогом увеличения выживаемости.
Необоснованное прекращение лечения может привести к необратимым изменениям и летальному исходу. Препарат выбора — D-пеницилламин. До сих пор он остается средством выбора и «золотым стандартом» в лечении болезни Вильсона.
Механизмы действия D-пеницилламина: образование хелатных комплексов с медью, которые выделяются с мочой, и перевод внутриклеточной меди в неактивное состояние. Препарат рекомендуется принимать натощак (за 30 мин до еды), так как пиша уменьшает его абсорбцию.
Учитывая, что D-пеницилламин дает антипиридоксиновый эффект, к терапии необходимо добавлять пиридоксин в дозе 25 мг/л внутрь.
Схема лечения:
Первый этап — начальная фаза лечения. Начальная доза D-пеницилламина составляет 250—500 мг/сут, ее делят на 4 приема. Затем дозу постепенно увеличивают до 1-2 г/сут (каждые 7 дней на 250 мг), пока экскреция меди с мочой не повысится до 2000—5000 мкг/сут.
После достижения клинического улучшения, которое наступает через несколько месяцев от начала лечения, и снижения экскреции меди с мочой переходят на поддерживающую терапию.
В течение двух первых месяцев лечения клинический анализ крови (количество форменных элементов) и мочи (величина протеинурии) проводят каждые 2 нед, в течение следующих 6 мес — ежемесячно. Второй этап — поддерживающая терапия. Поддерживающие дозы составляют 0,75-1,25 г/сут. Экскреция меди с мочой уменьшается до 500— 1000 мкг/сут.
Ежегодно проводится исследование колец Кайзера — Флейшера в щелевой лампе. При адекватном лечении происходит уменьшение выраженности и полное исчезновение симптома у 80% больных через 3—5 лет после начала лечения.
Побочные эффекты при лечении D-пеницилламином делятся на ранние, являющиеся в начальной фазе лечения, и поздние, развивающиеся во время поддерживающей терапии.
Ранние побочные эффекты. В течение первого месяца терапии у 20% больных наблюдается появление или ухудшение неврологической симптоматики. Это связано с мобилизацией меди из печени, повышением ее концентрации в ЦНС.
В этой ситуации необходимо снизить дозу до 250 мг/сут и постепенно повышать ее до увеличения экскреции меди с мочой. Если неврологическая симптоматика продолжает ухудшаться, то D-пеницилламин заменяют другим медь-хелатирующим препаратом (см. ниже).
Ухудшение неврологической симптоматики в первые месяцы лечения необходимо дифференцировать с прогрессированием самого заболевания при применении низких доз D-пеницилламина. В течение первого месяца лечения у 20% больных развиваются реакции гиперчувствительности — лихорадка, кожный зуд, сыпь и — редко — лимфаденопатия.
Эти симптомы проходят после временной отмены препарата. Терапию D-пеницилламином возобновляют в дозе 250 мг/сут в комбинации с преднизолоном в дозе 20—30 мг/сут. В течение месяца дозу D-пеницилламина увеличивают, постепенно отменяя преднизолон.
Поздние побочные эффекты. Развиваются у 5-7% пациентов и обычно манифестируют после года лечения.
Наиболее частыми из них являются кожные изменения: пеницилламиновая дерматопатия, пемфигус, acantosis nigricans, elastosis perforans serpinginosa, lichen planus.
У 3-5% больных развиваются синдромы, сходные с аутоиммунными заболеваниями: синдромом Гудпасчера, системной красной волчанкой, миастенией. При развитии этих осложнений, а также при появлении значительной протеинурии (более I г/сут) D-пеницилламин отменяют и назначают триентин. Триентин. Используется с 1969 г.
как альтернативный медьхелатирующий агент у пациентов, интолерантных к D-пеницилламину. При переходе на триентин большинство побочных эффектов D-пеницилламина исчезает. Дозы триентина составляют 1—2 г в день, разделенных на 3 приема. Препарат принимают натощак. Наиболее тяжелым побочным эффектом является сидеробластная анемия. Цинк.
Использование цинка при болезни Вильсона основано на его способности увеличивать синтез медьсвязывающих белков в эпителии тонкой кишки и в гепатоцитах. Это препятствует абсорбции меди из ЖКТ и обеспечивает перевод меди в нетоксичное состояние. Ежедневные дозы сульфата или ацетата цинка составляют 150 мг в день, разделенных на два-три приема.
Препарат назначают между приемами пищи. Цинк относительно безопасен, из побочных эффектов наиболее частыми являются расстройства со стороны ЖКТ и головная боль. Целесообразно использование цинка у асимптомных больных на ранних стадиях заболевания и в качестве поддерживающей терапии у пациентов, которым предварительно проводилась терапия медьхелатирующими препаратами.
Одновременное назначение хелаторов меди и препаратов цинка не рекомендуется. Тетратиомолибдат. Механизмами действия этого препарата являются: образование комплексов с медью в ЖКТ и сыворотке крови, что препятствует соответственно ее абсорбции и проникновению в ткани. Рассматривается как потенциально более эффективный хелатор меди, чем D-пеницилламин и триентин.
В настоящее время имеются только ограниченные данные о клиническом использовании этого препарата. Суточная доза составляет 120—200 мг. В качестве побочных эффектов описано угнетение костномозгового кроветворения. Лечение хелаторами меди во время беременности не должно прекращаться.
Рекомендуемые дозы D-пеницилламина, составляющие 0,75—1 г/сут, не представляют риска для плода. Если планируется кесарево сечение, то за 6 нед до родоразрешения и на весь срок до заживания послеоперационной раны дозу D-пеницилламина необходимо снизить до 250 мг/сут.
Показаниями к трансплантации печени при болезни Вильсона являются: печеночная недостаточность, ассоциированная с гемолизом и гиперурикемней; прогрессирование печеночной недостаточности, не поддающейся медикаментозной коррекции. Показатели однолетней выживаемости после трансплантации составляют около 80%.
Генная терапия.
В последние годы обсуждается вопрос о возможности замещения в печени дефектного гена болезни Вильсона нормальным.
Однако ввиду значительных технических трудностей этот вопрос является пока предметом дискуссии.
Источник: https://ruslekar.com/publ/sovremennye_metody_diagnostiki_i_lechenija_nekotorykh_zabolevanij/bolezn_vilsona_konovalova_gepatolentikuljarnaja_degeneracija/5-1-0-238
Болезнь Вильсона-Коновалова: симптомы, причины, диагностика и лечение болезни Вильсона-Коновалова
Диагностика гепатолентикулярной дегенерации включает в себя визуальный осмотр, оценку симптомов, пальпаторное обследование печени, а также лабораторные исследования.
Во время личного осмотра врач уточняет у пациента, есть ли у него наследственная предрасположенность к гепатолентикулярной дегенерации, осматривает глаза на предмет выявления характерного коричневого кольца.
При пальпации отмечается гепатомегалия.
При диагностике гепатолентикулярной дегенерации используются такие лабораторные методики:
- ДНК-маркеры. Данный метод диагностики даёт возможность точно установить наличие этого наследственного недуга;
- биохимия крови. Позволяет определить уровень меди в крови;
- биопсия печени;
- анализ мочи на наличие в ней меди.
Существует ещё один информативный метод диагностики патологии у детей и взрослых – использование меченой меди. Её вводят в организм, а потом наблюдают, в каком органе она будет накапливаться.
Приведенные сроки продолжительности жизни пациентов при современном уровне медицины удается значительно увеличить при помощи раннего начала лечения болезни Вильсона-Коновалова и использования всех возможных средств.
Питание пациента должно проводиться согласно диетическому столу №5а (для заболеваний печени). Исключаются все острые блюда, жареные и жирные. Одновременно для ограничения поступления меди с пищей категорически запрещаются: изделия и натуральные продукты, содержащие шоколад, орехи, кофе, мясо печени, раков и кальмаров, сухофрукты, бобовые, крупы из цельной пшеницы.
Основное направление — обеспечение вывода излишков меди. Главным препаратом считается D-пеницилламин. Препарат назначается с небольшой дозы по схеме, затем она увеличивается. Необходимо учитывать пожизненный прием лекарства и его негативные свойства.
Специалисты обращают внимание на низкое качество отечественного Пеницилламина, его токсичность. У некоторых пациентов с гепатолентикулярной дегенерацией побочные явления заключаются в дерматитах, анемии
Другое направление — терапия солями цинка (сульфат, оксид). Применение комбинаций D-пеницилламина с препаратами цинка позволяет проводить терапию низкими дозами и избегать отрицательных последствий. Если заболевание выявлено до начала клинических проявлений, то рекомендуются только препараты цинка. Дополнением является использование Унитиола.
В обязательном порядке пациенту назначаются гепатопротекторные средства: витамины, Эссенциале. Для поддержки проводимости в нервных волокнах необходимы витамины группы В. Предложен способ био-гемоперфузии крови с живыми изолированными клетками печени и селезенки. Методику называют «вспомогательной печенью».
Она проводится в специализированных центрах при безуспешной терапии для поддержки организма пациента до операции трансплантации печени. Пересадка здоровой печени донора помогает решить множество проблем лечения.
Сама операция требует подготовки больного, учета рисков в связи со сниженной свертываемостью крови. Это наиболее радикальный метод лечения форм болезни с преобладающим поражением печени.
Эффективность лечения значительно улучшается при ранней диагностике. Удается достичь уменьшения проявлений. Пациенты остаются социально адаптированными людьми: способны полностью к самообслуживанию, учатся, работают по профессии, создают семью. Имеются наблюдения за молодыми женщинами с болезнью Вильсона-Коновалова, выносившими беременность и родившими здоровых детей.
Раз эффект лечения болезни зависит от раннего выявления и начала, то семьям, в которых есть ребенок с гепатолентикулярной дегенерацией, необходимо обследовать его братьев и сестер с применением современных молекулярно-генетических методик. Знание будущих родителей о своем носительстве предотвратит рождение больного малыша.
Лечение этого недуга является трудной задачей даже для опытных специалистов. Болезнь Вильсона-Коновалова — это синдром, объединяющий поражение головного мозга и других органов и систем вследствие накопления в организме меди.
Патологию называют также гепатолентикулярной дегенерацией, поскольку первой на ее возникновение реагирует печень. Существует и другое синонимическое название болезни — гепатоцеребральная дистрофия. Она указывает на поражение гепатоцитов и центральной нервной системы.
Лечение болезни длительное и трудное, а прогноз относительно выздоровления пациента неблагоприятный.
При обнаружении патологии на ранней стадии возможно немедикаментозное лечение. Здесь может помочь соблюдение диеты, которую необходимо организовать так, чтобы в организм поступало минимальное количество меди вместе с пищей. Запрещается пить обычную воду, а необходимо употреблять только дистиллированную.
После диагностики заболевания обязательно назначается лекарственная терапия, которая помогает сдерживать симптомы гепатолентикулярной дегенерации. Из препаратов используются:
- Хелаты, которые помогаю выводить медь из организма.
- Препараты, которые блокируют всасывание меди из желудка.
- Иммуносупрессоры.
- Противовоспалительные средства.
- Поливитамины и микроэлементы.
- Препараты цинка.
- При нарушении неврологических функций – препараты, помогающие контролировать их развитие.
- Гепатопротекторы.
- Антиоксиданты.
- Назначенные дозировки нельзя изменять самостоятельно, а также нельзя по своему желанию отменять то или иное лекарственное средство.
- По жизненным показаниям может быть проведено хирургическое вмешательство, и чаще всего здесь применяется пересадка печени.
- Аутосомно-рецессивный тип наследования болезни Вильсона. 25 % вероятность рождения больного у родителей-гетерозигот
Ген болезни Вильсона — Коновалова(ATP7B) расположен в длинном плече 13-й хромосомы (13q14.3). Ген кодирует P-тип АТФазы, которая транспортирует медь в жёлчь и включает её в церулоплазмин. В 10 % случаев мутация не обнаруживается.
Хотя описано почти 300 мутаций ATP7B, в большинстве популяций болезнь Вильсона возникает в результате небольшого количества мутаций, специфичных для этих популяций.
Например, для западных популяций мутация H1069Q (замена гистидина на глутамин в позиции 1069 белка) присутствует в 37-63 % случаев заболевания, в то время как в Китае эта мутация очень редка и R778L (замена аргинина на лейцин в позиции 778) встречается чаще.
Относительно мало известно о влиянии мутаций на течение заболевания, хотя по данным некоторых исследований мутация H1069Q предполагает более позднее начало неврологических симптомов.
Нормальные вариации в гене PRNP могут изменить течение болезни, увеличивая возраст появления заболевания и влияя на тип симптомов, которые развиваются. Этот ген кодирует прионный белок, который активен в головном мозге и других тканях, а также, как полагают, участвует в транспорте меди.
У заболевания аутосомно-рецессивный тип наследования. То есть больной должен получить дефектный ген от обоих родителей (см. на рисунке). Люди только с одним мутантным геном называются носителями (гетерозиготы). У них могут возникать слабовыраженные нарушения метаболизма меди.
Pfizer рассказывает о транстиретиновой амилоидной кардиомиопатии 14.11.2019
Специалисты сходятся во мнении, что необходимо привлечение внимания общественности к проблемам сердечно-сосудистых заболеваний. Некоторые из них являются редкими, прогрессирующими и трудно диагностируемыми. К таким относится, например, транстиретиновая амилоидная кардиомиопатия
Источник: https://mir-logiki.ru/bolezn-vilsona-konovalova-ili-gepatocerebralnaa-distrofia/