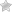А.А. Серёгин, В.Е. Загайнов, А.С.Чичканова
ФБУЗ «Приволжский окружной медицинский центр» Федерального медико-биологического агентства
Частота злокачественного поражения печени, первичного и метастатического, составляет от 60 до 90%. Наиболее частым (более 50%) источником метастазирования является рак толстой кишки. Статистика заболеваемости злокачественными поражениями печени ужасающая. В России ежегодно диагностируется более 6000 случаев первичного рака печени и более 130 000 случаев метастатического рака печени.
Классическая методика лечения больного со злокачественным поражением печени включает два основных этапа: хирургическое удаление первичного опухолевого очага и системное химиотерапевтическое лечение.
Однако к моменту диагностики радикальная операция на печени, как при первичном, так при метастатическом поражении, возможна только у 5-15% больных.
У 60-80% пациентов, перенесших резекцию печени в отдаленном периоде наблюдается рецидив и прогрессирование метастатического поражения.
Таким образом, паллиативная химиотерапия требуется более чем 70% больных со злокачественным поражением печени. При внутривенном введении терапевтическая концентрация достигается лишь на короткое время и в ряде случаев не оказывает необходимого воздействия на опухолевые клетки.
Эффективность системной химиотерапии при неоперабельном поражении не превышает 20% при выживаемости 3–4 месяца.
Даже при использовании комбинаций нескольких препаратов частота объективного ответа составляет не более 30%.
Выраженные нарушения детоксикационной функции печени определяют высокую опасность системного применения химиопрепаратов из-за возможного быстрого прогрессирования печеночной недостаточности.
Большой объем поражения, трудности достижения терапевтической концентрации химиопрепарата в зонах поражения, высокая токсичность противоопухолевых препаратов ставят под сомнение успех традиционной системной лекарственной химиотерапии.
В последнее время в лечении больных нерезектабельным первичным и метастатическим раком печени стали применяться методы интервенционной радиологии. Они обладают рядом преимуществ по сравнению с системной химиотерапией.
Введение препарата непосредственно в артериальное русло печени и метастатических узлов позволяет достигнуть локально терапевтической концентрации при значительно меньшем общем объеме лекарственного средства.
Дополнительная окклюзия артерий печени увеличивает время нахождения препарата непосредственно в метастатических узлах, усиливая лечебный эффект.
В ряде случаев регионарная внутриартериальная химиотерапия с применением современных цитостатиков позволяет перевести неоперабельных пациентов в разряд операбельных.
Техника чрезкатетерной артериальной химиоэмболизации была впервые предложена в 1970-ые годы доктором Ямада (Yamada) и соавт.
Метод основан на особенности кровоснабжения опухолей печени. Нормальная паренхима имеет двойное кровоснабжение: из воротной вены – до 70%, из печеночной артерии – 30%, в то время как кровоснабжение опухолевого узла до 95% осуществляется из ветвей печеночной артерии.
Такая сосудистая архитектоника позволяет селективно вводить высокие дозы химиопрепарата непосредственно к опухоли, предотвращая или значительно уменьшая воздействие химиопрепарата на здоровые клетки печени, а также, исключая ишемическое и токсическое повреждение паренхимы.
Развитие химиоэмболизации можно разделить на три этапа.
Метод начинался с введения селективно в печеночную артерию измельченной желатиновой губки, насыщенной противоопухолевыми препаратами: 10 мг митомицина С или 20 мг адриамицина [6,8].
Недостатком методики была низкая абсорбирующая способность желатиновой губки и быстрое ее растворение, что снижало время воздействия химиотерапевтического препарата на опухоль.
В 80-е годы прошлого столетия было сделано наблюдение, что инъекция масляного йодированного сложного эфира, выделенного из масла маковых зёрен, липиодола, способна проникать и задерживаться в опухолях, таких как первичная гепатоцеллюлярная карцинома и метастазы кишечного и нейроэндокринного рака в печень. Было обнаружено, что липиодол способен на длительное время накапливать химиопрепараты, что позволяло достигнуть двойного эффекта – эмболизации артерий с прекращением кровотока в опухоли и ее некроза, а также увеличение времени нахождения химиопрепарата в области поражения.
Новым этапом развития метода химиоэмболизации было открытие и внедрение в клиническую практику микросфер.
В настоящий момент существуют 2 типа микросфер, предусматривающих возможность лекарственного насыщения: микросферы Hepasphere (Biosphere Medical Inc., Франция) и DC Bead (Biocompatibles, Великобритания).
Сверхабсорбирующие Hepasphere — это биосовместимые, гидрофильные (абсорбирующие) нерезорбируемые микросферы, изготовленные из акрилового сополимера и предназначенные для эмболизации печёночной артерии, с возможностью впитывать жидкости в объёмах в 64 раза превышающих объём микросфер в сухом виде.
Степень увеличения размера микросфер зависит от концентрации ионов в окружающей среде. Размер частиц в сухом виде варьируется от 50 до 200 мкм, и в насыщенном виде от 200 до 800 мкм соответственно. Сверхабсорбирующие микросферы насыщаются доксорубицином непосредственно перед их введением.
Микросферы DC Bead являются первыми пренасыщенными микросферами. Они изготавливаются из полимерного гидрогеля, модифицированного добавлением сульфокислоты, что позволяет полимеризировать их для получения сферических частиц различного размера и насыщаются доксорубицином непосредственно при производстве.
При использовании микросфер в опухоли достигается тройной эффект, а именно: доставка химиопрепарата, механическая эмболизация за счет слипания микросфер в прекапиллярном русле и продолжительное контролируемое высвобождение препарата.
Чрезкатетерная артериальная химиоэмболизация позволяет использовать широкий спектр лекарственных препаратов, таких как доксорубицин, цисплатин и митомицин С и др.. До настоящего времени нет достоверной информации о том, какие из химиопрепаратов наиболее эффективны.
Наиболее часто используемый в монотерапии препарат – это Доксорубицин, а также комбинация цисплатина, доксорубицина и митомицина С. Однако, несмотря на высокие внутриопухолевые концентрации, ни одно рандомизированное исследование не показало преимуществ одного препарата над другими.
Есть предположение, что эмболизация питающего опухоль сосуда увеличивает эффективность вводимых химиопрепаратов только после того, как химиотерапия проведена в полном объёме.
Таким образом, при химиоэмболизации решается несколько задач: доставка химиопрепарата непосредственно к опухолевому узлу, предотвращение вымывания лекарственного препарата из опухоли и провокация ишемического некроза.
Согласно критериям Gates et al., (1999) показаниями для химиоэмболизации были: достаточные функциональные резервы печени (билирубин не более 70 ммоль/л), отсутствие внепеченочного распространения опухоли, морфологические формы опухоли, при которых химиоэмболизация эффективна (метастазы колоректального рака, рака молочной железы, гепатоцеллюлярный рак), гемоглобин более 80 г/л.
Процедура химиоэмболизации ветвей печеночной артерии включала два этапа: диагностический и лечебный.
Под местной анестезией проводили чрескожную пункцию и катетеризацию бедренной артерии, в которой устанавливали интродъюссер.
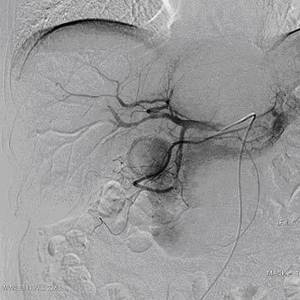
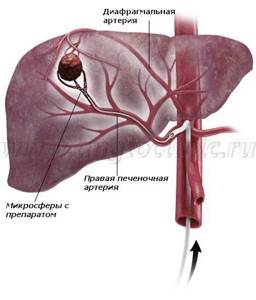
В печеночную артерию вводили специальный катетер и выполняли селективную ангиографию с контрастированием артериального русла печени с целью оценки ангиографической морфологии внутрипеченочных опухолевых узлов, локализации и количества питающих их сосудов, наличия артериальных анастомозов при повторных вмешательствах.
Для катетеризации печеночной артерии в сложных анатомических случаях был сконструирован собственный катетер особой формы, который позволил значительно ускорить процедуру катетеризации печеночной артерии, обеспечить его стабильное положение в сосуде и, тем самым, снизить лучевую нагрузку на пациента и медицинский персонал.
Катетер устанавливали в ветвь печеночной артерии, питающей опухолевый узел, стабилизировали его для профилактики осложнений, связанных с попаданием эмболизирующих частиц в артерии поджелудочной железы, желудка, а также тонкого кишечника и осуществляли введение химопрепарата.
Для выполнения, так называемой, масляной химиоэмболизации в качестве эмболизата применяли эмульсию, состоящую из химиопрепарата и липиодола. Средний объем вводимой эмульсии составил 20 мл. Применяли следующие химиопрепараты Доксорубицин (от 50 до 100 мг), Митомицин С (от 5 до 10 мг), Гемзар (от 600 до 1000 мг).
Дозу препарата выбирали в зависимости от размеров поражения, биохимических показателей крови, характеризующих печеночный цитолиз, объема дистального артериального русла, питающего опухолевый узел.
Масляную химиоэмболизацию дополняли механической окклюзией ветвей печеночной артерии мелконарезанной гемостатической губкой, в том числе у пациентов с частичным тромбозом ствола воротной вены и с ранее перевязанной правой ветвью воротной вены.
При использовании Hepasphere окклюзии проводили только сферами без применения гемостатической губки.
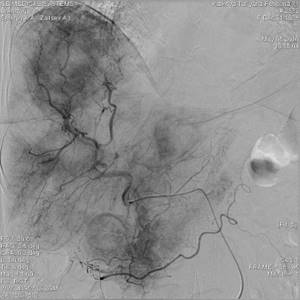
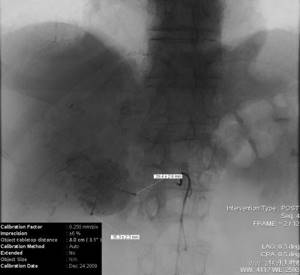
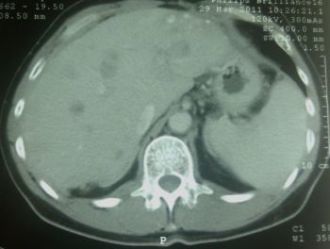
| Фото 1. Ангиограмма общей печеночной артерии (паренхиматозная фаза). В обеих долях печени визуализируются метастатические очаги рака толстой кишки. |
| Фото 2. Ангиограмма правой печеночной артерии. В правой доле печени визуализируются очаги (первичный рак), накапливающие эмболизат. |
| Фото 3. Ангиограмма правой печеночной артерии. В правой доле печени визуализируются очаги (первичный рак), накапливающие эмболизат. |
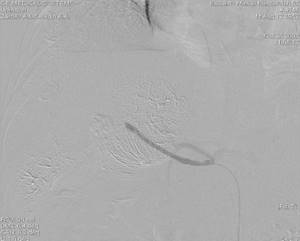
| Фото 4. Ангиограмма правой печеночной артерии. Окклюзия правой печеночной артерии после введения гемостатической губки. |
В качестве химиопрепарата использовался Доксорубицин 50–100 мг, Оксаллиплатин 100 мг, Гемзар 500–1000 мг , Митомицин С 10 мг . После процедуры осуществляли механическую окклюзию ветвей печеночной артерии гемостатической губкой (1 см2), в том числе у пациентов с частичным тромбозом ствола воротной вены и с ранее перевязанной правой ветвью воротной вены.
Курсы масляной химиоэмболизации повторяли первые полгода – 1 раз в 2 месяца, вторые полгода – 1 раз в 3 месяца, далее – один раз в шесть месяцев.
При эмболизации Hepasphere первым этапом выполняли эмболизацию правой печеночной артерии, вторым этапом (через 3-4 недели) – эмболизацию левой печеночной артерии. Далее через 1 месяц проводили повторную компьютерную томографию для оценки эффективности вмешательства.
Эффективность процедуры оценивали по критериям RECIST (Response Evaluation Criteria in Solid Tumors 1.1 (2009 г.). Полный или частичныйэффект – уменьшение объема опухоли более чем на 25 %.
Стабилизация – уменьшение объема опухоли менее чем на 25 % или отсутствие увеличения образования и появления новых очагов в печени.
Прогрессирование – увеличение размеров опухоли или появления новых очагов в печени.
Летальных исходов и осложнений, связанных с техническим выпол¬нением процедур, не было. Постэмболизационный синдром наблюдали у всех па¬циентов, включая боль в правом подреберье, высокую температуру тела, тош¬ноту, реже – рвоту. Эти симптомы, а также по-вышение уровня ферментов печени купировали консервативно в течение 2 – 7 суток.
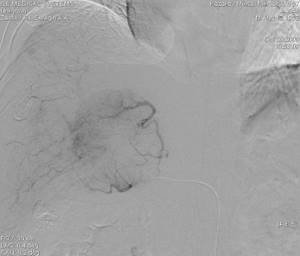
| Фото 5. Ангиограмма правой печеночной артерии. В правой доле печени визуализируются очаги (первичный рак), накапливающие эмболизат. |
| А | Б |
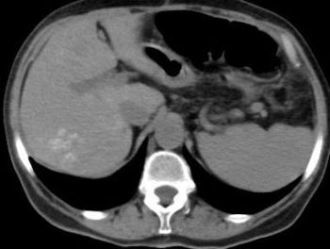
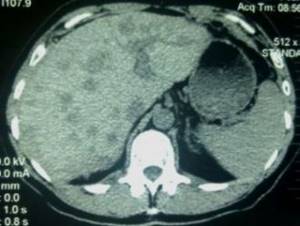
| Фото 6. Фототомограммы больной Ж., 70 лет. Сравнение томографической картины печени после химиоэмболизации печеночной артерии. | |
| А). Состояние печени через 1 месяц после первого курса эмболизации. В правой доле печени визуализируются метастатические очаги, в которых сохраняется эмболизат, введенный во время процедуры. Б). Состояние печени через 1 месяц после втоого курса эмболизации. В правой доле печени узел не визуализируется (положительная динамика). |
| А | Б |
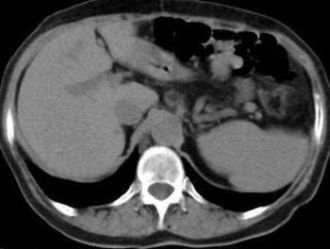
| Фото 7. Фототомограммы больного Т., 45 лет. Сравнение томографической картины после химиоэмболизации печеночной артерии. | |
| А). Состояние печени до лечения. В обеих долях печени визуализируются множественные метастатические очаги. Б). Состояние печени через 1 год после начала лечения. Отмечается резкое уменьшения количества и размеров метастатических очагов (положительная динамика). |
Результаты внутриартериальной химиоэмболизации при злокачественном поражении печени сопоставимы с данными литературы. Мы оцениваем их как удовлетворительными.
Рентгеноэндоваскулярное лечение было эффективно более, чем у 40% пациентов, несмотря на то, что у большинства из них было по¬ражение обеих долей печени и пациенты признаны неоперабельными.
Низкая частота ос¬ложнений и летальности, умеренная токсичность позволяют рекомендовать артериальную химиоэмболизацию в качестве метода лечения опухолевого поражения.
Результаты артериальной химиоэмболизации с применением микросфер Hepasphere также оценены как удовлетворительные.
У всех больных отмечен положительный эффект, подтвержденный результатами лучевых методов исследования (ультразвуковое исследование, компьютерная и/или магнитно-резонансное исследования, ангиография).
Считаем, что положительная динамика и продолжительный эффект лечения обусловлен достижением высокой концентрации химиопрепарата, его длительной экс¬позицией на фоне ишемии опухоли. Больные относительно хорошо переносили вмешательство, системные токсические эффекты успешно купировали.
Данная операция выполняется в клинической больнице № 1 ФБУЗ ПОМЦ ФМБА России по квоте, т.е. бесплатно.
Тел. отделения: 8(831)421-69-79 (по будним дням с 9.00 до 16.00)
Перейти на страницу отделения
Источник: http://www.pomc.ru/publication/13504
Химиоэмболизация печени: что это такое, противопоказания к химиоэмболизации печени
Химиоэмболизация печени — метод лечения рака, который относится к сфере интервенционной хирургии. Суть методики состоит в том, что в сосуд, питающий опухоль, вводят сразу два препарата:
- Эмболизирующий препарат представляет собой микросферы. Они блокируют приток крови к злокачественной опухоли, лишая ее кислорода и питательных веществ.
- Химиопрепарат накапливается и затем высвобождается эмболизирующими частицами. Тем самым обеспечивается его доставка непосредственно к опухолевой ткани, он не поступает в системный кровоток и не оказывает токсичных эффектов на организм.
В чем преимущества химиоэмболизации?
Химиоэмболизация — «двойной удар» по злокачественной опухоли. Эффективность этого метода лечения довольно высока: примерно в 2/3 случаев удается остановить рост опухоли или существенно сократить ее размеры.
Эффект сохраняется в течение 10–14 месяцев, в зависимости от типа рака. В будущем химиоэмболизацию можно повторить. Процедура хорошо сочетается с другими видами лечения, такими как хирургия, химиотерапия, радиочастотная аблация, лучевая терапия.
В то же время, химиоэмболизацию печени вполне можно применять и как самостоятельный вид лечения.
Одна из распространенных проблем химиотерапии — риск серьезных побочных эффектов. К тому же, рак печени практически не реагирует на системную химиотерапию.
Химиопрепараты помогают лишь в случае, когда их вводят непосредственно в печеночную артерию. Именно это и происходит при химиоэмболизации.
Процедура дает возможность применять препарат в высоких, эффективных дозах, при этом он не оказывает системных токсических эффектов.
Злокачественные опухоли печени главным образом опасны тем, что со временем они приводят к тяжелой печеночной недостаточности. Именно от нее погибают многие больные. Химиоэмболизация помогает остановить рост опухоли, сохранить функцию печени и обеспечить для пациента приемлемое качество жизни.
Немного о кровоснабжении печени
Печень — один из немногих органов, который имеет двойное кровоснабжение:
- По воротной вене в нее оттекает кровь от кишечника. Из этого сосуда получают большую часть кислорода и необходимых веществ нормальные клетки печеночной ткани — гепатоциты.
- Печеночная артерия отходит от чревного ствола — артерии, которая является ветвью аорты. Она обеспечивает печень кровью на 25–30%, из нее получают кислород и питательные вещества опухолевые клетки.
Если ввести эмболизирующий препарат в печеночную артерию, можно эффективно уничтожить опухолевую ткань, практически не повредив здоровую и сохранив функцию печени.
В каких случаях можно проводить химиоэмболизацию печени?
Химиоэмболизацию можно применять как при первичном (гепатоцеллюлярная карцинома, холангиокарцинома), так и при метастатическом раке печени. Чаще всего метастатические очаги в печеночной ткани встречаются при раке толстой кишки, молочной железы, легких, простаты.
Врач может порекомендовать химиоэмболизацию, если невозможно удалить опухоль или выполнить трансплантацию печени из-за высоких рисков, если не удается провести радиочастотную аблацию из-за больших размеров очага (диаметр более 5 см).
Важно понимать, что цель химиоэмболизации печени — не уничтожить опухоль, а уменьшить ее размеры, затормозить рост, сохранить функцию печени и продлить жизнь пациента. Это не радикальный метод лечения.
В настоящее время химиоэмболизацию применяют не только при раке печени, но и при злокачественных опухолях почек, поджелудочной железы, раке шейки матки и других онкологических заболеваниях.
Существуют ли противопоказания?
При некоторых состояниях проводить химиоэмболизацию печени не рекомендуется:
- Тяжелое нарушение функции печени и/или почек.
- Нарушение оттока желчи.
- Недавно перенесенное хирургическое вмешательство, стентирование желчных протоков.
- Нарушение свертываемости крови.
Если у пациента нарушена работа печени, врач должен тщательно оценить все за и против. В некоторых случаях химиоэмболизацию проводят, несмотря на риски. При этом эмболизирующий препарат с химиопрепаратом вводят в небольших дозах.
Какие препараты применяют для химиоэмболизации печени?
Еще в 80-х годах прошлого века врачи начали проводить масляную химиоэмболизацию. В сосуд, питающий опухоль, вводили масляный рентгеноконтрастный препарат, в котором находились химиопрепараты.
Эффективность такого метода была довольно низкой.
В опухоли не удавалось создать высокую концентрацию химиопрепарата в течение длительного времени, он вызывал системные побочные эффекты, а масляный раствор не мог заблокировать кровоток в самой опухолевой ткани.
Прорыв произошел в начале XXI века, когда были созданы эмболизирующие препараты на основе микросфер. Эти микросферы могут накапливать и затем высвобождать химиопрепарат.
В настоящее время химиоэмболизацию печени проводят двумя препаратами: DC Bead и Hepaspheres.
DC Bead
Препарат DC Bead производит британская компания Biocompatibles. На территории Европы и России он представлен японской компанией Terumo — одним из лидирующих мировых производителей оборудования для эндоваскулярной хирургии и онкологии.
Препарат состоит из микросфер, изготовленных из поливинилалкоголя. Они могут иметь диаметр от 100 до 900 микрон, каждый размер соответствует диаметру сосуда, в котором нужно перекрыть кровоток.
В зависимости от размера частиц, флакон с препаратом имеет определенную цветовую маркировку.
На поверхности микросфер DC Bead осажден доксорубицин — основной химиопрепарат, который применяют для химиоэмболизации. После введения препарата он выделяется в течение 14 дней.
Hepaspheres
Препарат Hepaspheres производит Biosphere Medical — подразделение американской компании Merit Medical, которая выпускает препараты и устройства одноразового применения для радиологии, кардиологии, онкологии.
Микросферы изготовлены из сополимера винилацетата и метилакрилата. Они могут иметь диаметр 30–60, 50–100, 100–150 или 150–200 микрон. В воде их размеры увеличиваются в 4 раза.
Микросферы Hepaspheres, как и DC Bead, применяют в сочетании с химиопрепаратом доксорубицином.
Как проводят химиоэмболизацию печени?
Обычно процедура продолжается около 1,5 часа. Ее выполняет эндоваскулярный хирург в операционной. Для того чтобы предотвратить некоторые осложнения, применяют лекарственные препараты:
- аллопуринол — для защиты почек от химиопрепаратов и продуктов разрушения опухолевых клеток;
- лекарства для профилактики тошноты;
- антибиотик — для профилактики инфекции.
Подключают датчики, которые контролируют сердечный ритм и артериальное давление пациента. Обычно вмешательство проводят в состоянии седации: внутривенно вводят препараты, которые погружают пациента в состояние «медикаментозного сна». Иногда применяют общий наркоз.
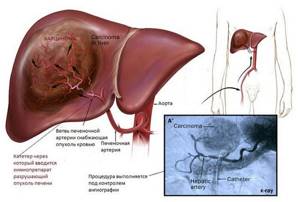
В верхней части бедра делают небольшой надрез и вводят катетер в бедренную артерию. Его продвигают под контролем рентгена, пока его кончик не достигнет печеночной артерии. Через катетер вводят рентгеноконтрастный раствор, чтобы оценить расположение сосудов. Когда кончик катетера оказывается в питающей опухоль ветви артерии, вводят эмболизирующий препарат вместе с химиопрепаратом.
Делают рентгеновские снимки, чтобы убедиться, что препарат введен правильно, извлекают катетер, на бедро накладывают повязку.
Эффективность
Химиоэмболизацию печени практикуют в онкологии уже достаточно давно, в разных клиниках проведено много таких процедур. Это рутинный, уже, можно сказать, проверенный временем метод лечения.
Его эффективность доказана в ходе научных исследований.
Например, клиническое исследование, проведенное в Барселоне с участием 27 пациентов, показало, что выживаемость после химиоэмболизации печени в течение одного года составляет 92%, в течение двух лет — 89%.
В Афинах было проведено исследование с участием 71 пациента. Выживаемость в течение трех лет после лечения составила 76,4%.
Могут ли возникать осложнения после химиоэмболизации печени?
Возможны такие осложнения, как боль в животе, повышение температуры, занесение инфекции в печень, повреждение здоровой ткани при неправильном введении препарата, воспаление в желчном пузыре, образование тромбов в сосудах. Современные технологии помогают минимизировать риски. Серьезные осложнения в настоящее время возникают в 5% случаев.
Запись
на консультацию
круглосуточно
Источник: https://www.euroonco.ru/departments/interventsionnaya-onkologiya/himioembolizatsiya-pecheni
Химиоэмболизация опухоли печени в Израиле – как взять рак под контроль без операции?
Химиоэмболизация печени – малоинвазивный метод химиотерапии рака, при котором препараты доставляются непосредственно в очаг заболевания.
Они блокируют сосуды вокруг опухоли (эмболизация) и выполняют сразу две важных функции:
- Прекращают поступление крови к очагу онкологии
- Доносят химиотерапевтические лекарства в высоких дозах непосредственно в раковые ткани, где они постепенно высвобождаются, не задевая здоровые
Таким образом опухоль оказывается в условном капкане: не имея источника питания, она прекращает рост и уменьшается в размерах. Наиболее часто процедура применяется для лечения рака печени как основной способ терапии либо в комплексе с традиционной лучевой- и химиотерапией, радиочастотной абляцией, хирургическим удалением патологии. Химиоэмболизация в Израиле также эффективно используется при лечении рака молочной железы, толстого кишечника, меланомы, саркомы, первичных сосудистых опухолей, метастазов в печени. Важно понимать, что химиоэмболизация не является панацеей от рака. Основная задача данного метода лечения – приостановление роста опухоли, уменьшение ее в размерах, борьба с единичными метастазами и продление жизни пациента.
В ходе процедуры закупориваются кровеносные сосуды, осуществляющие питание опухоли, в то же время к очагу поражения доставляются препараты химиотерапии. На первом этапе в просвет главного сосуда, кровоснабжающего очаг онкологии, при помощи катетера доставляется необходимое количество лекарства. Затем он закрывается специальным синтетическим (эмболизирующим) материалом, и внутри очага постепенно происходит высвобождение противоопухолевого препарата.
- Масляная – в ходе процедуры вводятся масляные рентгеноконтрастные вещества, после чего кровеносные сосуды эмболизируются.
- Химиоэмболизация микросферами – полимерными гранулами, впитывающими химиотерапевтические препараты и помогающими создать стойкую необратимую закупорку кровеносных сосудов.
Наши специалисты преимущественно используют второй метод, поскольку он дает наилучший эффект – после закупорки сосудов лекарственные препараты высвобождаются в тканях опухоли в течение нескольких недель, затем ткани разрушаются и замедляют свой рост.
- Доставить большую концентрацию противоопухолевых препаратов непосредственно к очагу онкологии – это повышает эффективность лечения и снижает побочные эффекты, поскольку здоровые ткани не страдают.
- Замкнуть круг питания опухоли и оставить ее буквально один на один с противораковыми препаратами, прекратив питание свежей кровью. Кислородное голодание впоследствии вызовет ее гибель.
- Сохранить питание здоровой части опухоли за счет портальной вены: наша печень имеет два пути кровоснабжения. ¾ крови поступает через портальную вену и ¼ – через печеночную артерию. В ходе процедуры эмболизируется (закупоривается) именно печеночная артерия.
Процедура является минимально инвазивной и проходит под контролем рентген-аппарата специалистами по интервенционной радиологии. Как правило, она проводится однократно, однако если опухоль расположена в двух участках печени, через месяц после первой химиоэмболизации возможно проведение второй процедуры.
Перед химиоэмболизацией вам необходимо сдать анализ крови на свертываемость и проверку работы почек.
Кроме того, на предварительной консультации у специалиста вы должны сообщить перечень препаратов, которые принимаете на постоянной основе.
Аспирин и другие нестероидные противовоспалительные лекарства, антикоагулянты для разжижения крови в этот период исключаются. Непосредственно за 8 часов до манипуляции запрещен прием пищи.
Специалист оценивает состояние печени при помощи рентген-установки и выявляет сосуды, питающие опухолевые ткани. Поскольку основной побочный эффект данного метода химиотерапии направлен на ухудшение работы почек, вам назначается гепатопротектор, минимизирующий негативное влияние продуктов распада химиотерапии. Для профилактики возможных воспалений также могут быть показаны антибиотики и препараты, уменьшающие боль и тошноту. Собственно, сама процедура химиоэмболизации рака печени. Вас укладывают на специальный стол, подключают к аппарату, показывающему давление и пульс, при помощи внутривенного катетера вводят седативные препараты. Врач производит миниразрез в паху и вводит в него катетер, после чего постепенно продвигает его к очагу онкологии. Далее производится серия снимков печени.
Оказавшись непосредственно у питающей опухоль артерии, врач вводит в нее противораковый препарат, смешанный с эмболизирующим составом. Затем делает еще один снимок, подтверждающий успех процедуры.
Сама процедура длится не более 90 минут. После нее вам будет показан постельный режим еще в течение 6-8 часов. Швы на месте разреза, в который вводилась артерия, накладываются не всегда, в большинстве случае достаточно фиксирующей повязки. По рекомендациям наших специалистов и индивидуальным показателям вашего здоровья вполне возможно, вы проведете в клинике следующие два дня. Затем сможете вернуться домой.
В первое время после операции возможно наступление постэмболизационного синдрома в виде тошноты, рвоты, общего плохого самочувствия, повышения температуры.
Наиболее выраженным является болевой синдром, поскольку он вызван прекращением кровотока в месте опухоли. Для борьбы с этим состоянием вам назначат эффективную поддерживающую терапию на весь восстановительный период. Через неделю-две неприятные симптомы начнут уменьшаться, и вы сможете вернуться к привычному образу жизни.
ВАЖНО: в первый месяц после химиоэмболизации рака печени нужно регулярно проходить процедуры МРТ или КТ, сдавать общие анализы, чтобы отслеживать прогресс лечения. Делать это можно как в Израиле, так и на родине, поддерживая связь с лечащим врачом при помощи онлайн-консультаций.
Сегодня химиоэмболизации при раке печени является наиболее востребованной процедурой и эффективным способом борьбы с опухолью, в том числе с метастазами других видов онкологии. Более 80% таких манипуляций в Израиле проходят успешно и в итоге рост опухоли приостанавливается, она уменьшается в объемах либо очаги становятся менее плотными. Положительный эффект химиоэмболизации длится до 14 месяцев. В случае, если опухоль возобновит рост после полного растворения эмболизирующих частиц, процедуру можно провести повторно.
Часто химиоэмболизация используется как часть паллиативного лечения для облегчения онкологических симптомов пациентов с неоперабельным раком печени – она позволяет продлить жизнь и улучшить работу органа. В таком случае положительный эффект может пролонгироваться до двух с половиной лет.
Поскольку израильские специалисты отдают предпочтение персонализированной медицине, назвать конкретную стоимость химиоэмболизации невозможно – она рассчитывается индивидуально для каждого нашего пациента. Цена зависит от стадии развития заболевания, характера онкологического процесса, наличия метастаз, общего состояния здоровья. На нее также влияет стоимость противоопухолевых средств и эмболизирующих препаратов. Однако наш клинический опыт позволяет говорить, что она значительно ниже аналогичной процедуры в клиниках США и Европы.
Чтобы уточнить все интересующие вас подробности, свяжитесь с нами любым удобным способом, и мы с удовольствием ответим на ваши вопросы. С ценовой политикой некоторых обязательных диагностических процедур можно ознакомиться в соответствующем разделе нашего сайта.
Источник: https://www.dramedical.ru/news/onkologiya/khimioembolizatsiya-pecheni
Химиоэмболизация метастазов в печени
Химиоэмболизация метастазов в печени — метод основанный на блокировании кровотока в метастазе и введении в него химиопрепарата, убивающего раковые клетки. Преимущества химиоэмболизации перед обычной химиотерапией заключается в локальном воздействии больших доз химиопрепаратов именно на опухоль, а так же в гибели метастаза из-за блокирования его кровообращения.
Метастазирование в печень происходит из-за особенностей кровообращения в этом органе. Через печень проходит более 1,5 литров крови в минуту, кровь к печени доставляется не только по артериям, но и через систему воротной вены.
Причем около 75% кровоснабжения здоровой ткани печени осуществляется за счет воротной вены, кровоснабжение ткани опухоли происходит за счет ветвей печеночной артерии.
Именно эта особенность кровообращения позволяет успешно применять один из самых современных и эффективных способов лечения метастазов — суперселективную химиоэмболизацию ветвей печеночной артерии.
Смысл вмешательства заключается в подведении микрокатетера к сосуду, кровоснабжающему метастаз и введении через него специальных эмболов, блокирующих кровоток. Эти эмболы пропитаны химиопрепаратом, который локально действует именно на эту опухоль.
Химиоэмболизация может значительно увеличить продолжительность жизни у пациентов с метастазами и первичным раком печени. Лечение этим методом, при условии контроля и наблюдения является эффективным у 90% пациентов с данной патологией.
В нашей клинике методика химиоэмболизации метастазов в печени выполняется по направлению онколога опытными рентгеноэндоваскулярными хирургами. Операция планируется только после детального изучения сосудистого русла печени и опухоли на предварительном качественном МСКТ исследовании сосудов.
Наши специалисты выполняют полную блокаду кровотока в метастазе, применяя доступы к узлу со всех сторон, где подходят питающие сосуды. Для этого мы выполняем КТ в сосудистом режиме после проведения химиоэмболизации и выявляем остаточное русло опухолевого новообразования. После этого проводятся повторные катетеризации сосудов опухоли и процедуры ее эмболизации.
Химиоэмболизация подразделяется на 2 вида:
- Масляная эмболизация – процедура введения масляного химиоэмболизата, насыщенного цитостатиком. После введения масляный химиоэмболизат попадает в опухоль, разделяясь в сосудах на мелкие жировые капли, которые блокируют сосуды опухоли. Далее суспензия цитостатика постепенно выделяет лекарственный препарат непосредственно в ткань опухоли. Однако масляный химиоэмболизат не способен удерживать химиопрепарат в опухоли непродолжительное время.
- С целью увеличения эффективности процедуры, был разработан новый метод химиоэмболизации — химиоэмболизация микросферами. Химиоэмболизация микросферами способна обеспечить длительный контакт цитостатика со злокачественными клетками, что дает лучший эффект при лечении. Чтобы получить желаемый результат необходимо выполнять химоэмболизацию только у опытного рентгенэндоваскулярного хирурга в хорошо оснащенной рентгеноперационной и только в стерильных условиях.
Для планирования вмешательства пациенту необходимо установить точный диагноз и получить направление от онколога на данный вид лечения. С целью диагностики необходимо выполнить общеклинические анализы крови и мочи, анализ крови на свертываемость и биохимический. Для планирования операции необходимо выполнить качественное МСКТ артерий печени.
За день до операции пациенту следует прибыть в клинику. Пах и предплечья должны быть побриты. Врач предупреждает о возможных осложнениях и индивидуальных реакциях организма, берет информированное согласие на вмешательство и насыщает микросферы лекарственным веществом. Перед операцией пациенту предложат не завтракать и введут успокоительные и обезболивающие препараты.
Обезболивание
Суперселективная химиоэмболизация является сложной, но малотравматичной операцией, которая, обычно, проводится под местной анестезией. Общий наркоз требуется крайне редко.
В рентгеноперационной пациента укроют стерильным бельем, хирургическая бригада оденется в стерильную одежду.
Врач обработает место пункции растворами анестетиков так, чтобы пациент находился в сознании, адекватно отвечал на вопросы, но не чувствовал боли. После этого будет выполнена пункция (прокол) в бедренной артерии, через который хирург аккуратно проведен проводник и катетер (тонкую полую трубочку для введения контраста и микроэмболов).
Катетер проводится под рентгенологическим контролем непосредственно в печеночную артерию. Чем глубже и ближе к опухоли удается завести инструмент, тем более избирательным является действие микроэмболов и цитостатиков на опухолевые клетки.
После полного введения препарата катетер и проводник извлекаются, в области опухоли начинаются процессы некротизирования (омертвления) тканей. Операция обычно длиться не более двух часов. Пациент переводится в палату под наблюдение медицинского персонала. В послеоперационной палате необходимо провести 2-3 дня.
Обычно, проведение курса лечения проходит без серьезных осложнений, побочными эффектами могут быть тошнота, рвота, боли в месте формирования некроза. Контроль результатов лечения и выявление новых коллатералей (дополнительных сосудов опухоли или метастаза) выполняется посредством КТ контрастирования через каждые 3 месяца в течение первого года.
Суперселективная химиоэмболизация микросферами является этапным методом лечения, и для закрытия всех мелких сосудов опухоли и ее полного некроза чаще всего требуется от двух до пяти вмешательств.
Преимущества метода химиоэмболизации перед другими методами лечения очевидны — достаточно низкая травматичность процедуры; — применение при неоперабельных новообразованиях; — низкий показатель токсического воздействия химиопрепарата на организм человека; — возможность увеличить или понизить концентрацию химиопрепарата в зависимости от локализации и вида опухоли; — минимальный показатель риска осложнений во время и после операции.
Побочные эффекты химиоэмболизации связаны с механизмом ее лечебного воздействая. Прекращение кровообращения в опухолевом узле приводит к его гибели с распадом. Продукты распада могут всасываться в кровь и вызывать интоксикацию. Клинически это может проявляться повышением температуры тела, общим недомоганием по типу простудного заболевания.
Гибель опухоли вызывает воспалительную реакцию окружающих тканей и брюшины, что сопровождается болевым синдромом умеренной выраженности. Обычно для его купирования достаточно обычных обезболивающих препаратов.
В ответ на введение химиотерапевтических препаратов развивается соответствующие химиотерапии осложнения. Это может быть тошнота, рвота, выпадение волос, снижение количества лейкоцитов в крови. Однако подобные осложнения развиваются значительно реже, так как химиопрепарат вводится локально.
Повышенная температура тела может наблюдаться в течение недели после прохождения процедуры. Вполне нормальным явлением, наблюдающимся на протяжении двух-трех недель, считается повышенная физическая слабость и снижение аппетита.
Наибольшую опасность представляет инфицирование печени и повреждение ее тканей. Риск развития опасных для жизни осложнений после химиоэмболизации не превышает 1%.
Как правило, пациенты, прошедшие через процедуру химиоэмболизации, покидают стационар сразу после нормализации состояния, проявляющейся снижением болей и прекращением тошноты. Обычно это происходит к концу первых-вторых суток после операции. Для стабилизации состояния после выписки им назначают противорвотные средства, анальгетики и антибиотики, помогающие предотвратить развитие инфекции.
В послеоперационном периоде необходимо обращать внимание на показатели функции печени (обязательно сдаются биохимические анализы через 3 дня после процедуры), почек. Если процедура прошла без серьезных осложнений, то можно планировать следующий этап в ближайшее время.
Мы назначаем контрольное исследование МСКТ через 10 дней после проведенной процедуры, чтобы оценить динамику изменений в метастатическом очаге и его остаточное кровоснабжение. При сохранении кровообращения в узле через добавочные сосуды мы планируем следующий этап, позволяющий выключить эти источники кровоснабжения.
После достижения хорошего ангиографического и клинического результата мы выполняем МРТ или КТ печени через 6 месяцев, чтобы отследить поведение узлов в печени. Значительное их уменьшение или исчезновение говорит о правильности выбранного препарата и хирургического подхода. При появлении признаков возобновления роста мы выполняем дополнительные процедуры химиоэмболизации.
Подобный подход позволяет долгое время контролировать онкологический процесс и обеспечивает максимальную продолжительность жизни больным с запущенным раковым процессом.
Источник: https://angioclinic.ru/metodiki/himioembolizatsiya-metastazov/
Химиоэмболизация при первичном и метастатическом раке печени
- The Cancer Journal:
- March/April 2010 — Volume 16 — Issue 2 — pp 156-162
- Special Issue on Local Therapies in the Treatment of Liver Metastases: Review Article
Специальный выпуск, посвящённый методам регионарной терапии метастазов в печень. Обзорная статья.
Chemoembolization for Primary and Metastatic Liver Cancer
From the Division of Vascular and Interventional Radiology, The Russell H. Morgan Department of Radiology and Radiological Science, The Johns Hopkins Hospital, Baltimore, MD.
Доктор медицины, сотрудник секции Сосудистой и Интервенционной Радиологии Отделения радиологии и радиологической науки им Рассела Х. Моргана госпиталя им. Джона Хопкинса, Балтимор.
Transcatheter arterial chemoembolization (TACE) is one of the most commonly performed procedures in interventional radiology and is currently used for the palliative treatment of primary and metastatic hepatic malignancies.
A new type of TACE is TACE with drug-eluting microspheres, which is currently gaining wide acceptance worldwide.
In this article, we will review some technical components, patient selection, current results, and future directions of TACE and TACE with drug-eluting microspheres for primary and metastatic liver cancer.
Чрезкатетерная артериальная химиоэмболизация – это одна из наиболее практикуемых в интервенционной радиологии процедур. Обычно она применяется в качестве паллиативного лечения первичного и метастатического рака печени.
В настоящее время всё большее признание в мире получает новая разновидность артериальной химиоэмболизации – химиоэмболизация микросферами, насыщенными противоопухолевым препаратом.
В этой статье мы рассмотрим технические аспекты, подбор пациентов, текущие результаты и направления развития как обычной чрезкатетерной артериальной химиоэмболизации, так и химиоэмболизации насыщаемыми микросферами.
Transcatheter arterial chemoembolization (TACE) is a form of intraarterial catheter-based chemotherapy, used primarily for palliative treatment of primary and metastatic hepatic malignancies.
It is one of the most commonly performed procedures in interventional radiology, and over the past 20 years, it has significantly contributed to the evolution of this subspecialty.
TACE exploits the initial observation that most hepatic malignancies receive their blood supply largely by the hepatic artery and selectively delivers intraarterially high doses of chemotherapy to the tumor bed, while sparing the surrounding hepatic parenchyma.
A new variation of TACE is TACE with drug-eluting microspheres (TACE-DEM), which has recently emerged as a new form of catheter-based therapy, and it is currently gaining wide acceptance worldwide. In this article, we will review some technical components, patient selection, current results, and future directions of TACE and TACE-DEM for primary and metastatic liver cancer.
Чрезкатетерная артериальная химиоэмболизация – это вид интраартериальной химиотерапии, применяемый в первую очередь для паллиативного лечения первичных и метастатический опухолей печени. Это одна из наиболее часто проводимых процедур в интервенционной радиологии, оказавшая существенное влияние на развитие этой отрасли в последние 20 лет.
В чрезкатетерной артериальной химиоэмболизации используются особенности кровоснабжения опухолей печени, большинство из которых получают питание за счёт печёночной артерии. Таким образом, становится возможным селективно вводить высокие дозы химиопрепарата интраартериально в ложе опухоли, избегая повреждения здоровой паренхимы печени.
Новая разновидность чрезкатетерной артериальной химиоэмболизации – химиоэмболизация микросферами, насыщенными химиопрепаратом, в последнее время прочно утвердилась как один из методов чрезкатетерной терапии и завоёвывает всё большее признание во всём мире.
В этой статье мы рассмотрим технические аспекты, подбор пациентов, текущие результаты и направления развития как обычной чрезкатетерной артериальной химиоэмболизации, так и химиоэмболизации насыщаемыми микросферами.
The technique of transcatheter arterial chemoembolization (TACE) was introduced in the 1970s by Yamada et al.
, who intraarterially delivered gelatin sponge pieces permeated with 10 mg of mitomycin C or 20 mg of adriamycin, after superselecting the tumor feeding artery of unresectable hepatomas.
In the 1980s, the observation that the injection of an iodinated ester derived from poppy seed oil, lipiodol or ethiodol, can be selectively uptaken and retained by primary hepatocellular carcinoma (HCC) and hepatic metastases of colonic and neuroendocrine tumors, led to the establishment of this compound as an important part of the injected chemotherapeutic cocktail. Moreover, lipiodol was found to effectively lock in the chemotherapeutic agents, while leading to dual embolization and tumor necrosis.
Техника чрезкатетерной артериальной химиоэмболизации была впервые предложена в 1970-ые годы доктором Ямада (Yamada) и соавторами, которые вводили резаную желатиновую губку, насыщенную 10 мг митомицина С или 20 мг адриамицина, в питающий опухоль сосуд при нерезектабельных гепатомах.
В 1980-ые было сделано наблюдение, что инъекция йодированного сложного эфира, выделенного из масла маковых зёрен, липиодола или этиодола, способна проникать и задерживаться в опухолях, таких как первичная гепатоцеллюларная карцинома и метастазы(от греч.
metastazis — перемещение, смена положения) — отдалённый вторичный очаг патологического процесса, возникший перемещением вызывающего его начала (опухолевых клеток, микроорганизмов) из первичного очага болезни через ткани организма.
Перемещение может осуществляться через кровеносные или лимфатические сосуды, либо внутри полостей тела— например, в брюшной или грудной полости. кишечного и нейроэндокринного рака в печень. В результате это соединение стало важной частью химиотерапевтического коктейля.
Кроме того, было обнаружено, что липиодол способен вбирать в себя химиопрепараты, что позволяло достигнуть двойного эффекта – эмболизации и некроза опухоли.
A large variety of drugs including doxorubicin, epirubicin, cisplatin, and mitomycin C have been used with TACE. Currently, there is no good evidence for the best chemotherapeutic agent.
The most common chemotherapeutic drug used as a sole agent is doxorubicin, whereas the combination of cisplatin, doxorubicin, and mitomycin C is the most common combined drug regimen for the treatment of HCC.
7 All these drugs exhibit preferential extraction when delivered intrahepatically, and they can achieve favorable tumor drug concentration with concurrent low systematic drug load.
Despite their favorable and high intratumoral concentrations, most randomized controlled trials have failed to demonstrate advantage of one agent over another.
8 Some suggest that injectable volumes of chemotherapy and long-term arterial patency were improved by embolizing the tumor-feeding vessel(s) only after the entire dose of chemotherapy had been delivered.9 In the United States, the most common combination is the mixture of 100 mg of cisplatin (Bristol Myers Squibb, Princeton, NJ), 50 mg of doxorubicin (Adriamycin; Pharmacia-Upjohn, Kalamazoo, MI) and 10 mg of mitomycin C (Bedford Laboratories, Bedford, OH) diluted in 10 mL of water soluble contrast medium. This cocktail is then emulsified in an equivalent volume of lipiodol, and up to 10 mL.
Чрезкатетерная артериальная химиоэмболизация позволяет использовать широкий спектр лекарственных препаратов, таких как доксорубицин, цисплатин и митомицин С. На данный момент нет достоверной информации о том, какие из этих препаратов наиболее эффективены. Наиболее часто используемый в монотерапии препарат – это Доксорубицин, тогда как комбинация цисплатина, доксорубицина и митомицина С – это наиболее часто употребимое в комбинированной терапии сочетание препаратов при лечении гепатоцеллюлярной карциномы. Все эти препараты демонстрируют преференциальную экстракцию (дословно-предпочтительное извлечение, т.е. наилучшее излучение препарата) при внутрипечёночном введении и могут обеспечивать необходимую концентрацию препарата в опухоли при сравнительно низкой концентрации в системном кровотоке. Однако, несмотря на высокие внутриопухолевые концентрации, ни одно рандомизированное исследование не показало преимуществ одного препарата над другими. Есть предположение, что эмболизациявведение различных веществ (например, микрочастицы, металлическая спираль или пена поливинилового спирта) для уменьшения просвета или полной окклюзии кровеносных сосудов при опухолях, врожденной артериовенозной мальформации, ангиодисплазии, или разрыве артерии. питающего опухоль сосуда увеличивает эффективность вводимых химиопрепаратов только после того, как химиотерапияХимиотерапия — лечение какого-либо инфекционного, паразитарного или злокачественного заболевания с помощью ядов или токсинов, губительно воздействующих на инфекционный агент — возбудитель заболевания, на паразитов или на клетки злокачественных опухолей при сравнительно меньшем отрицательном воздействии на организм хозяина. Яд или токсин при этом называется химиопрепаратом, или химиотерапевтическим агентом. В отличие от фармакотерапии, в которой имеется всего два участника — фармакологический агент (лекарство) и подвергаемый его воздействию организм, в процессе химиотерапии имеется три участника — химиотерапевтический агент, организм хозяина и подлежащий убиению паразит, инфекционный агент или клон злокачественных опухолевых клеток. Отличаются и цели: целью фармакотерапии является коррекция тех или иных нарушений жизнедеятельности организма, восстановление или улучшение функций пораженных заболеванием органов и систем. Целью же химиотерапии является уничтожение, убийство или, по крайней мере, торможение размножения паразитов, инфекционных агентов или злокачественных клеток, по возможности с меньшим повреждающим действием на организм хозяина. Нормализация жизнедеятельности и улучшение функций поражённых органов и систем при этом достигаются вторично, как следствие уничтожения или ослабления причины, вызвавшей заболевание — инфекции, опухоли или паразитарной инвазии. Виды химиотерапии В соответствии с тем, на уничтожение чего направлена химиотерапия, выделяют:
- 1. антибактериальную химиотерапию, или антибиотикотерапию;
- 2. противогрибковую химиотерапию;
- 3. противоопухолевую (цитостатическую, или цитотоксическую) химиотерапию, использующую противоопухолевые препараты, цитостатические препараты;
- 4.противовирусную химиотерапию;
5. противопаразитарную химиотерапию, в частности антигельминтную, противомалярийную и др.
Источник: http://chemoemboli.ru/node/573